如何获得高质量免疫组化(IHC图像)

由于免疫组化染色过程中存在很多步骤或环节,每一个步骤或环节都可能影响到染色的最终结果,因此,要做好一张高质量的免疫组化切片并不是一件非常容易的事,下面总结了几点小问题,希望能给到帮助。![]()
组织取材要快,不宜过大,太大太厚的组织不利于均匀一致的固定,取材厚度应小于5mm,避免人为损伤。
![]()
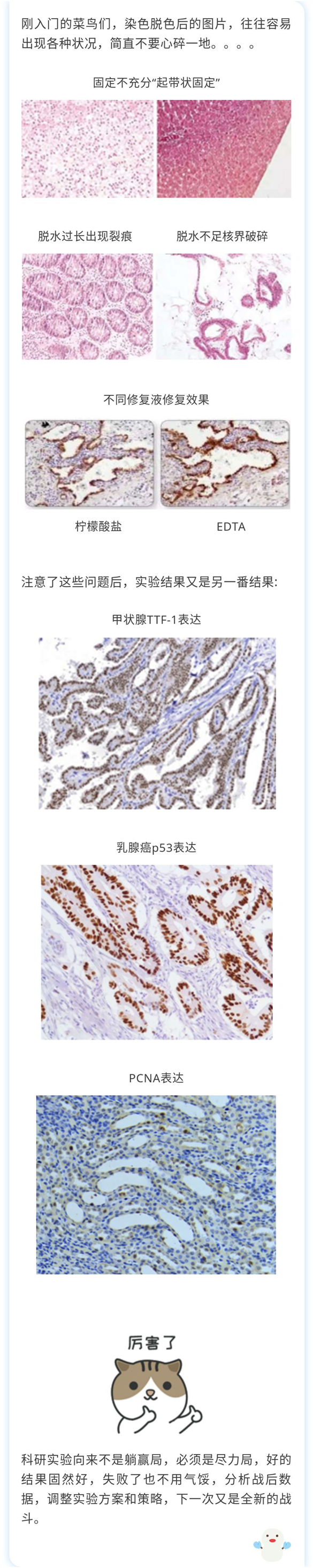
固定的目的是①防止标本从玻片上脱落;②除去防碍抗原-抗体结合的类脂,使抗原抗体结合物易于获得良好的染色结果;③固定的标本易于保存。组织取材后应即刻固定,常用固定液有中性甲醛、4%多聚甲醛(推荐使用),固定体积10倍于组织,固定时间6-24小时,固定时间不够或过长,都有可能引起抗原丢失。
![]()
切片的质量关系着免疫组化染色好坏,保持切出的组织完整、平整,切片皱褶、边缘卷曲会造成之后试剂难以洗净,显色时这些区域着色会增强。
![]()
三级二甲苯脱蜡,每次脱蜡15分钟,脱蜡彻底,二甲苯使用次数不宜太多,每100张片子更换一次(每周更换一次也是可以的)。
![]()
由于组织中部分抗原在甲醛或多聚甲醛固定过程中,发生了蛋白之间交联及醛基的封闭作用,从而失去抗原性;通过抗原修复,使得细胞内抗原决定族重新暴露,提高抗原检测率。修复方法有酶修复、高压热修复、微波热修复,不同抗原有各自最适的修复方式,对大多数的抗原来说微波热修复都能得到很好的效果。对于修复液大多数使用PH6.0的柠檬酸钠修复液,但大多数的抗体使用EDTA(PH8.0或9.0)修复液效果好于PH6.0的柠檬酸钠修复液![]()
一抗孵育条件在免疫组化反应中最重要,包括孵育时间、温度和抗体浓度。一抗孵育温度有几种: 4 度、室温、37 度,其中 4 度效果最佳;孵育时间:这与温度、抗体浓度有关,一般 37 度 1-2h,4 度过夜(从冰箱拿出后 37 度复温 45min) 。具体条件还要摸索。二抗孵育条件:二抗一般室温或 37 度 30min-1h,具体时间需要摸索......
![]()
显色液应现配现用,肉眼或显微镜下观察,当有明显棕色出现,应终止显色,显色时间不宜过长造成背景染色。