2型糖尿病心肌病(DCM)动物模型造模方法
2型糖尿病心肌病(DCM)是糖尿病所致心血管系统损害中重要并且独立的慢性并发症之一,其发病不依赖于冠状动脉疾病、高血压、心瓣膜病及其他已知心脏疾病,表现为糖尿病患者的心肌结构和功能发生改变,出现心肌代谢紊乱和心肌纤维化,左心室肥厚、舒张期和(或) 收缩期功能障碍,并最终导致心力衰竭。
目前,基础研究中应用的2型DCM动物模型多样,主要包括诱发性模型(C57BL/6小鼠、Webster小鼠、SD大鼠、Wistar大鼠)、自发性模型(ob/ob小鼠、db/db小鼠、KKay小鼠、OLEFT大鼠、ZDF大鼠、GK大鼠)和转基因模型(OVE26小鼠),后两种模型因价格昂贵,饲养条件要求高限制其应用,而诱发性模型因对其他组织影响小,动物易存活,且操作成熟简单,既符合2型DCM发生的实际病理过程,又便于开展实验研究,故目前应用较广泛。
2型DCM诱发性模型常用STZ联合高糖高脂饲料诱发胰岛素抵抗,按自然病程发展为DCM。常用实验方法为高脂饲料喂养结合一次性腹腔注射STZ或多次小剂量腹腔注射STZ,实验操作时需注意药物的注射方法和剂量。
一:材料
1)实验动物 280-320g SPF级雄性SD或Wistar大鼠;
2)药物、试剂与设备 链脲佐菌素(STZ);柠檬酸钠缓冲液;10%中性甲醛;生理盐水;2. 5%戊二醛;医用酒精;医用棉球;采血针;血糖试纸;血糖仪。
二:造模方法
1)实验大鼠适应性喂养1周;
2)以高糖高脂饲料(蔗糖20%,猪油10%,胆固醇2%,胆酸盐1%,普通饲料67% ) 自由进食、高糖高脂乳制(蔗糖30%,猪油20%,胆固醇10%,胆酸钠2% ) 3 mL·kg-1·d-1灌胃和蔗糖水(蔗糖含量0. 05g·mL-1)) 自由饮用的方法联合喂养6周;
3)第7周末称量体质量,若体质量≥正常组体质量均值+ 2倍标准差者为食源性肥胖大鼠,可进行造模。禁食12 h后造模大鼠一次性低剂量腹腔注射 STZ (溶解于pH 4. 5,0. 1 mmol·L-1枸橼酸钠缓冲液中,制成1% STZ 溶液) 28 mg·kg-1 后以原饲料继续喂养。STZ注射后造模组每周监测空腹血糖,12周后经尾尖端采血测空腹血糖(禁食8 h) ,将空腹血糖≥11. 1 mmol·L-1,且有多饮、多尿、多食、体质量减轻等现象的大鼠纳入实验。
三:观察指标
1)一般情况观察 :每天观察实验大鼠活动状态、毛色、精神状态、饮食、二便、体质量情况;定期医用酒精消毒大鼠尾尖后,用采血针扎破尾尖采血、测定并记录空腹血糖( FBG)的变化

图注1:实验鼠活动状态观察
2)超声心动图检查:实验大鼠以异氟烷吸入麻醉后仰卧位固定,M型超声模式下记录实验鼠心脏舒张期室间隔厚度(IVS:d)、舒张期左室内径(LVID:d)、舒张期左室后壁厚度(LVPW:d)、收缩期室间隔厚度(IVS:s)、收缩期左室内径(LVID:s)、收缩期左后室壁厚度(LVPW:s)及射血分数(EF%)值。每只大鼠至少观察3个连续的心动周期,取平均值计算;
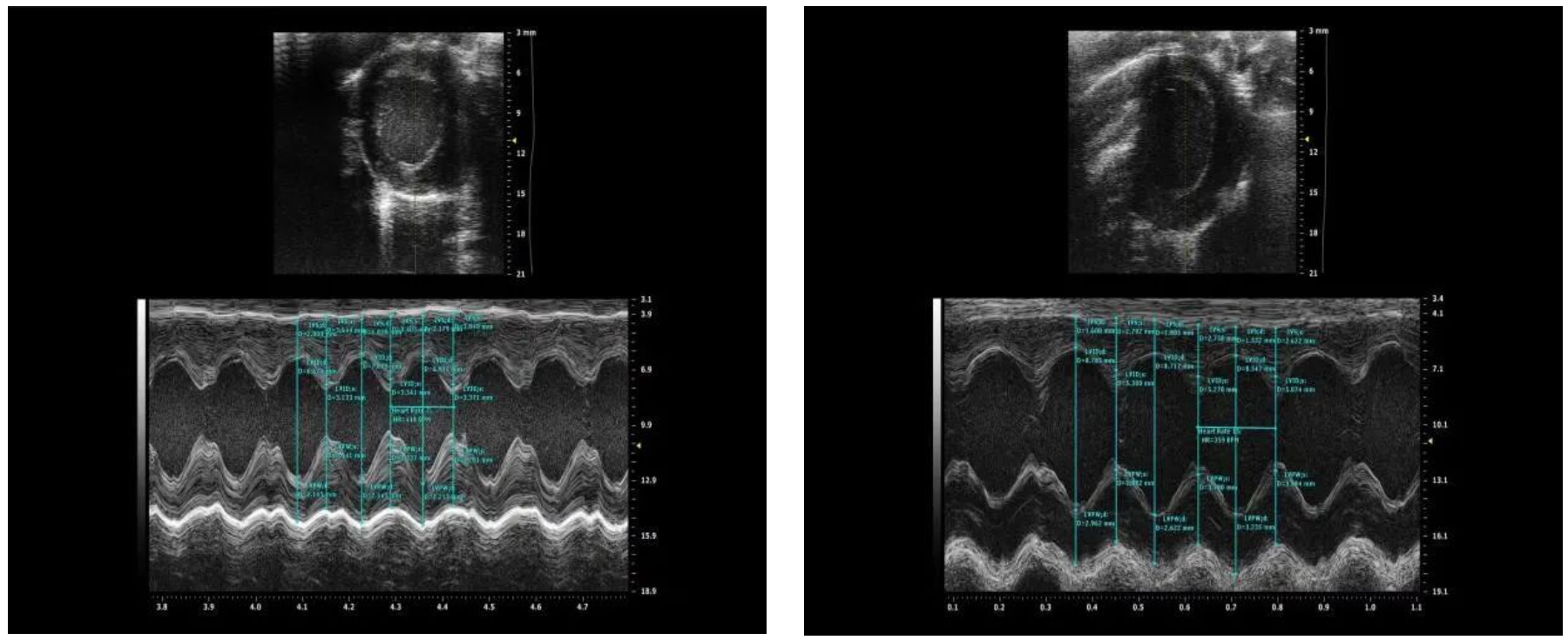
图注2:超声心动图——造模前(左)与造模后(右)
3)心脏指数测定:实验末期,禁食12 h实验鼠以异氟烷吸入麻醉后仰卧位固定,腹主动脉取血,生理盐水灌注完毕后迅速处死大鼠取出心脏,预冷盐水反复冲洗后剪除包膜和血管,用电子天平称质量并计算心脏指数(HMI) (mg·g-1) = (心脏质量/体质量);
4)血生化指标测定:使用全自动生化分析仪检测空腹血糖( FBG),总胆固醇( TC),甘油三酯(TG),低密度脂蛋白胆固醇(LDL-C),高密度脂蛋白胆固醇(HDL-C ) ; 使用ELISA 试剂盒检测糖化血红蛋白(HbA1c),空腹胰岛素(FINS);
5)心肌组织形态学观察:垂直于心脏左室长轴对称中点上下切取部分心肌,10%中性甲醛固定左心室心肌组织,常规脱水,石蜡包埋,行①HE 染色;②Masson染色,用Image-Pro Plus 6. 0图像处理系统计算切片每个视野中的心肌胶原分数(CVF =同一图像中胶原面积/所测视野面积),每张切片随机选取4个视野拍照取其平均数,排除富含胶原的血管和疤痕区域;③电镜观察,取心尖部组织,大小1.0mm×1.0mm×1.0mm,2. 5%戊二醛固定心尖部心肌组织,乙醇、丙酮梯度脱水,环氧树脂包埋,制作超薄切片,行醋酸铀、柠檬酸铅双染色。
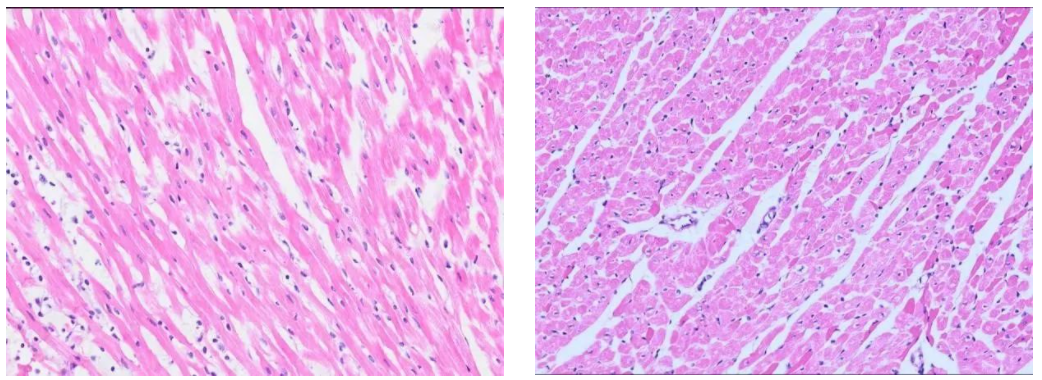
图注:HE染色(200X)——造模前(左)造模后(右)



