别迷糊!基因鼠的正确鉴定,这些内容要早知道
关于上期我们聊到了基因鼠的起源与发展,今天就来跟大家分享怎么去鉴定它。
如何鉴定基因鼠
1.鉴定基因鼠可以取小鼠的脚趾或尾尖(<5mm),一般1-2mm即可获得足够量 DNA 用于基因型鉴定。断趾操作一般剪取的鼠爪量为鼠爪趾尖组织,但若需要在剪趾作基因鉴定的同时,以剪趾作为小鼠的标记,则应尽量将整个脚趾剪下,以免后续组织长回愈合后分辨不清小鼠的编号。
2.剪趾或剪尾最好在出生后7-12天内完成,一方面既可避免母鼠吃仔,另一方面该时段的大小鼠容易抓取、出血较少,提取的基因组质量较高。
3.想要获得正确的鉴定信息,首先要正确取样,即避免小鼠在剪趾或剪尾过程的污染。如果上一只小鼠的血液和体液残留在剪刀上,就会将它的 DNA 带到下一只小鼠的组织上;而使用这样的组织做鉴定,则会导致假阳性的出现。
正确的做法应当是在每一次剪鼠尾之前,都用75%酒精擦拭清洁剪刀;或准备两把剪刀轮流使用,用完的剪刀浸泡在75%酒精溶液中。
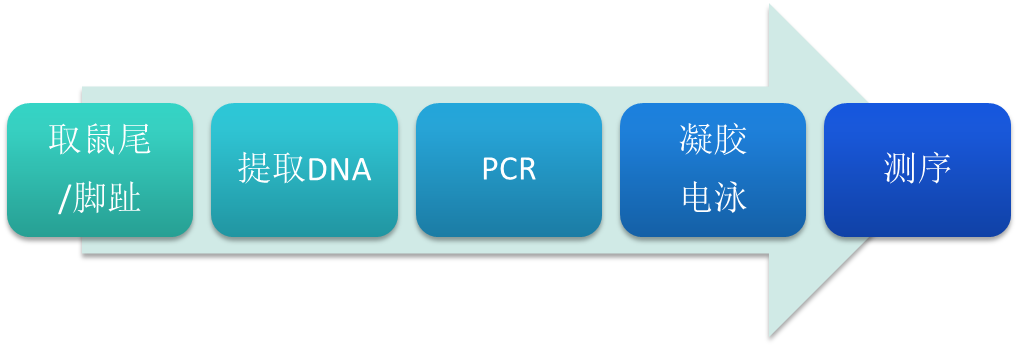
鉴定流程
取需要鉴定的小鼠鼠尾或脚趾,按试剂盒步骤提取DNA,进行聚合酶链式反应后,凝胶电泳鉴定。鉴定阳性后,可将PCR产物进行测序,从而进一步确认小鼠的基因型。
完全性基因敲除鼠的鉴定之一对引物
将引物设计在敲除区域的两端,如下图所示F1和R1引物。
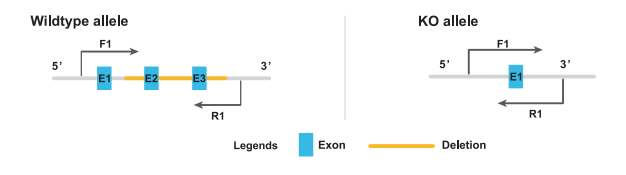
敲除后的基因片段比原来的野生型基因片段要短,因而可以通过凝胶电泳看PCR产物的大小来判断基因型。
预期的电泳结果示意图如下:
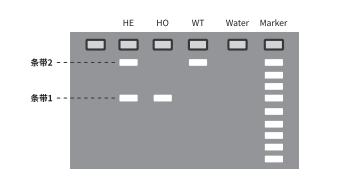

若电泳结果只有条带1,则判断为阳性纯合鼠(-/-);若电泳结果只有条带2,则判断为野生鼠(+/+);若电泳结果有条带1和条带2,则为阳性杂合鼠(+/-)。
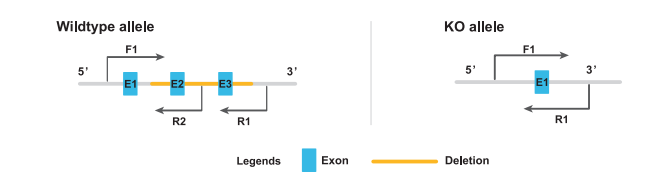
完全性基因敲除鼠的鉴定之两对引物
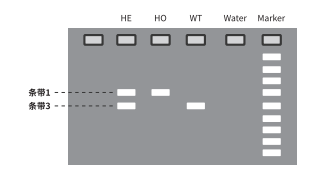
若敲除的片段过大,不精提基因组或不使用高保真高扩增效率的聚合酶,一般大于2,000 bp的条带会较难扩増。即图示中敲除区域大于2,000 bp时,野生型条带无法扩增,电泳结果中将无条带2。则只能区分野生型鼠和阳性鼠,无法判定阳性鼠是否为杂合或纯合。此时就需要再设计一条位于敲除区域内的引物R2(如下图所示),使用3条引物用短片段体系即可判断基因型。
预期的电泳结果示意图如下:
若电泳结果只有条带1,则判断为阳性纯合鼠(-/-);若电泳结果只有条带3,则判断为野生鼠(+/+);若电泳结果有条带1和条带3,则为阳性杂合鼠(+/-)。
若两对引物预期片段大小相差仅几十 bp ,在有实验误差的情况下,同一胶图可能较难区分两条条带。因此,一般是将三条引物分2个体系进行,先判断是否阳性,再进一步判断纯杂合。

点突变小鼠的鉴定
许多疾病的发生和点突变更密切相关,所以构建点突变的小鼠模型也很常见,但点突变小鼠的基因型鉴定稍复杂一些。由于点突变只是单碱基或少数碱基的增加、缺失或替换,在电泳图上突变片段与野生型条带的大小是无法区分的。因此,点突变小鼠除了PCR外,还需要结合测序或者酶切来鉴定。
选择在发生点突变的上下游片段设计引物(如下图所示)。若突变后的序列正好是某种酶特异识别的位点,在设计引物时还要使酶切点两边的片段大小有区分。
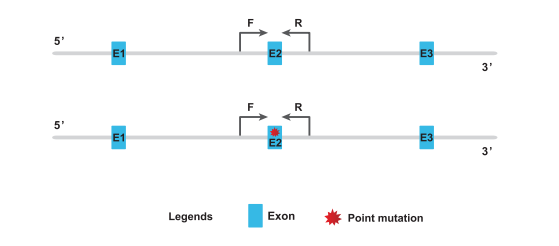
若突变后的序列正好是某种酶特异识别的位点,就可以用酶切实验进行验证。酶切成功则发生点突变的片段被切为两段,野生型的不会被酶识别切割。反之,若突变前的序列正好是某种酶特异识别的位点,也可同理进行鉴定。
但这两种情况均极罕见。使用引物扩增后电泳,通过条带大小只能大概判断扩增产物是否为目的基因。想要判断是否有突变,还需要切胶回收,送去测序。测序结果可在DNAMAN等软件上比对分析,即可判断目的碱基是否有突变。
本期内容分享到这里啦,欢迎大家在评论区讨论,留言您想了解的话题或相关知识。更多拓普资讯,可致电:0755-86325431,我们竭诚为您服务



