【拓普课堂】构建稳定表达细胞株
构建稳定表达细胞株的基本原理是将外源DNA克隆到具有某种抗性的载体上,载体被转染到宿主细胞并整合到宿主染色体中,用载体中所含抗性基因进行筛选,可得到稳定表达目的蛋白、或者稳定表达沉默特定基因的细胞株,即稳转株。
构建稳转株主要有两种方法:线性质粒瞬时转染法和慢病毒感染法。质粒转染受制于质粒大小、转染介质的限制,对很多细胞转染效率低,而且质粒整合入细胞基因组的效率极低,所以构建稳转株的成功率不高。而慢病毒几乎可以感染所有种类的细胞,并且在感染后容易整合到受感染细胞的基因组,进行长时间稳定表达,因此,慢病毒是目前用于构建稳转细胞株最主流的方法。
构建流程以及注意事项
1. 慢病毒载体构建,过表达载体或者干扰载体构建
慢病毒过表达载体有基因容量限制,对于大于5k的基因,包装出慢病毒的概率很低,不建议包装病毒。同时大于3k的目的基因也可能有不出毒或者出毒量低,在做正式实验之前,可用先进行病毒的小量包装,成功后再进行病毒大量包装。对于敲低,通常的策略是对一个基因同时选择3个干扰靶点,通过qPCR验证干扰效率之后,使用效率好的靶点进行下一步实验。
慢病毒载体带有不同的标签,如果研究细胞定位,可以选择带荧光标签的慢病毒载体,比如带GFP/RFP等;如果准备筛选稳转细胞株,可以选择带筛选标签的慢病毒载体,比如puro/neo等载体;如果目的基因大小适中,也可以选择同时带荧光标签和筛选标签的载体。
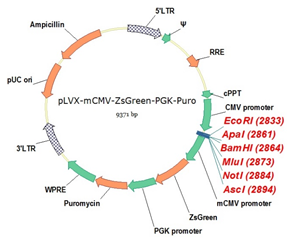
慢病毒过表达载体,同时带puro抗性、GFP荧光
2. 293T细胞培养及慢病毒包装
细胞的状态对于病毒包装有很大的影响,如果细胞状态不好可能不出毒或者出毒量很低。取状态良好,处于对数生长期的293T细胞进行慢病毒包装。第三代四质粒包装质粒配比,可以按照分子量来折算,并在附近量做实验,摸索最适质粒配比,以得到更高滴度的病毒。
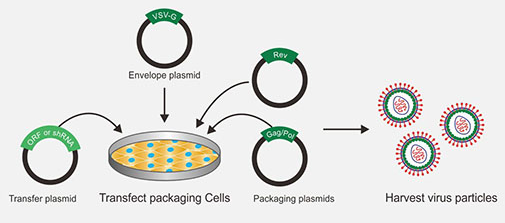
慢病毒包装图
3. 慢病毒滴度检测及保存,使用荧光梯度稀释法或者qPCR法检测
慢病毒表达时间较慢,荧光表达所需时间较长,建议感染后72小时后观测荧光表达或者qPCR检测。感染期间请根据细胞生长的情况对细胞进行及时换液,以保证细胞良好的生长状态。值得考虑的是使用低浓度的血清来培养细胞,作用是抑制细胞增殖。
特别注意,慢病毒可以存放于-80℃6个月以上,但如果病毒储存时间超过6个月,建议在使用前重新滴定病毒滴度。反复冻融会降低病毒滴度,每次冻融会降低病毒滴度10%,因此,在病毒使用过程中应尽量避免反复冻融,强烈建议收到病毒后按照每次的使用量将病毒进行分装。
4. 目的细胞MOI值摸索,确定最适慢病毒感染复数
同一种细胞在不同实验室中由于传代次数、操作细节的不同,细胞状态会有所差异,另一方面病毒液在运输、保存过程中可能造成即时滴度的变化。因此为了达到最佳的实验效果,建议在正式实验前进行3-4种不同MOI的感染预实验。细胞汇合度对抗生素筛选结果的影响很大,一般筛选时细胞汇合度不宜超过50%。
5. 目的细胞药物筛选浓度确定-通过梯度实验
使用不同浓度的抗生素对细胞进行处理,选择出在10-14天内使细胞全部死亡的最低抗生素浓度来进行下一步的筛选试验。不同的细胞对于同一种抗生素,其筛选浓度不同,而同一种细胞对于不同的抗生素,其最佳使用浓度也不同。所以在进行稳转株筛选之前,一定要先进行药物浓度筛选预实验以确定最佳药物筛选浓度。
6. 慢病毒感染目的细胞筛选稳转株
由于基因转染到细胞内之后要一段时间才能表达出蛋白质,所以筛选不能太早,但是也不能太晚,因为转染了外源基因的细胞代谢负荷较大,增值较慢,时间长了就会被没有外源基因转入的细胞所淹没,最终导致筛选不出阳性克隆。一般在转染24小时之后才开始加抗生素记性筛选。加药筛选后,死亡的细胞会裂解释放出有害物质,导致那些有抗生素表达的阳性细胞死亡,即非选择性死亡,因此要及时换液。
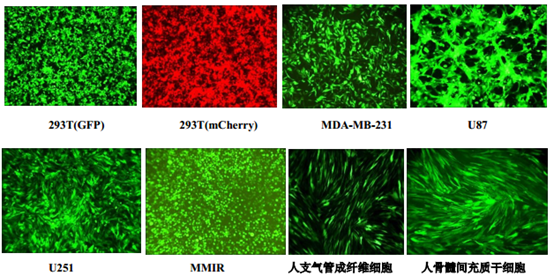
筛选的稳转株图
7. 稳转株检测
通过qPCR或者Western Blot检测目的基因,需要注意的是,mRNA的表达水平可能和蛋白的表达水平不一致,如果需要进一步研究蛋白的功能,可以使用WB检测蛋白的表达水平。
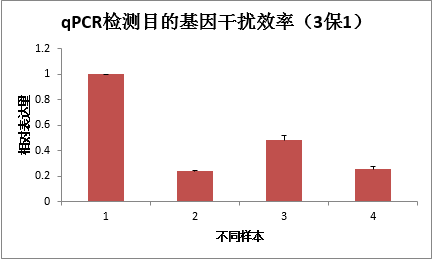
干扰稳转株qPCR检测
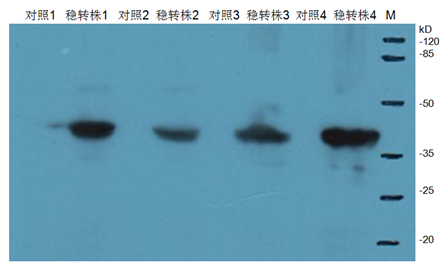
过表达慢病毒稳转株Western Blot检测(4株不同细胞)
一般需要构建稳定株的情况如下:
1. 长期在目的细胞中研究基因功能,通过构建稳定株,可以大大降低频繁转染或者病毒包装的成本,也极大方便实验研究;
2. 部分蛋白半衰期极长,瞬时 RNA 只能干扰表达,无法去除已经表达的目的蛋白,通过构建稳定株可以实现更好的基因干扰效果;
3. 瞬转往往会引入极高拷贝数的表达,导致因为人为因素造成实验结果的不精确,构建稳定株可以帮助筛选拷贝数适量的细胞进行实验研究;
4. 需要用诱导表达系统的,主要是一些致死基因或者是需要时空表达的;
5. 需要用细胞做动物实验的,比如裸鼠成瘤等,往往需要构建成稳转株。


