【拓普课堂】细胞毒性试验,你get到了吗?
细胞毒性是由细胞或化学物质引起的单纯细胞杀伤事件,不依赖于凋亡或坏死的细胞死亡机理。药物筛选常常要涉及到特定物质对细胞毒性的检测。有研究显示化学物质体外细胞毒性与其引起的动物死亡率及人体死亡的血药浓度之间都存在良好的相关性。化学物质产生的损伤和死亡,最终可表现为细胞水平上的改变,由此推测体外细胞毒性可以预测体内急性毒性。利用细胞毒理学比较多种检测终点、不同组织和种属的预测能力,发现啮齿动物细胞系对啮齿动物急性毒性,人源细胞系对人体急性毒性均有良好的预测能力。
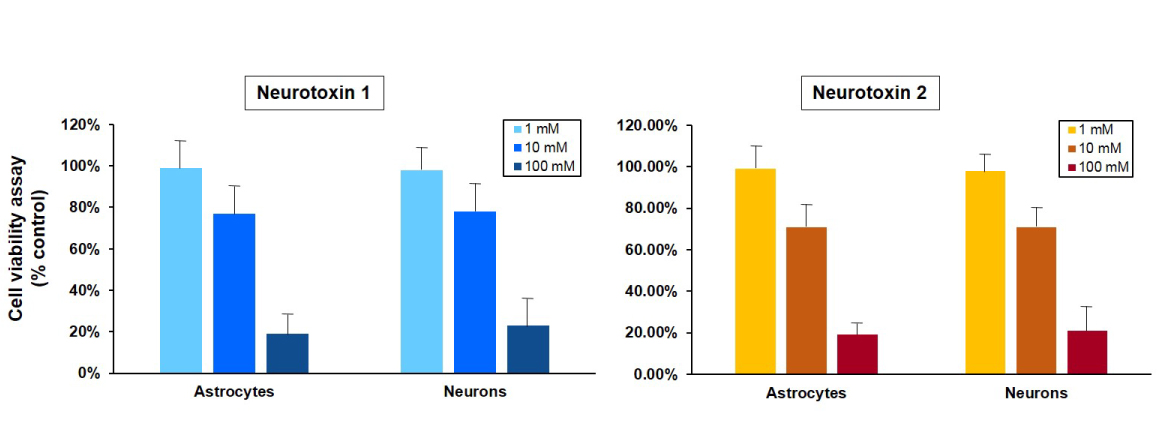
体外方法有助于预测化学物质急性暴露引发的全身和局部影响,并评估体内毒性浓度。因此进行急性毒性检测前首先进行体外细胞毒性分析,然后根据RC预测模型进行LD50值预测,选择体内急性毒性最适宜的开始剂量,减少实验动物的使用。
CCK-8法检测细胞增殖和毒性分析
CCK8全称为cell counting kit-8试剂,可用于简便而准确的细胞增殖和毒性分析。该试剂的关键组分是水溶性唑盐WST–8:化学名:2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐,它在电子载体1-Methoxy PMS的作用下被细胞线粒体中的脱氢酶还原为具有高度水溶性的黄色甲臜产物。生成的甲臜物的数量与活细胞的数量成正比。用酶联免疫检测仪在450nm波长处测定其光吸收值,可间接反映活细胞数量。
CCK-8法 KO MTT 法的优势:
重复性优于MTT;
CCK-8法对细胞比较友好,毒性小,线性范围更宽,灵敏度更高;
水溶性,不需要换液,尤其适合于悬浮细胞;
CCK-8法细胞毒性检测步骤可以按照试剂盒说明一步一步来即可,这里就不在累赘了,但是,重点来了!tips还是非常重要滴,拿走不谢~~
1、首次做实验时,建议先做几个孔摸索接种细胞的数量和加入CCK8试剂后的培养时间;
2、接种时注意细胞悬液一定要混匀,以避免细胞沉淀下来,导致每孔中的细胞数量不等,可以每接种几个孔就混匀一下;
3、悬浮细胞与贴壁细胞相比较难显色。对于悬浮细胞在加入CCK-8培养1-4小时后,可先从培养箱中取出,目测染色程度或用酶标仪测定决定。若显色困难,可将培养板放回培养箱,继续培养数小时后再确定;
4、 加CCK-8试剂时,斜贴着培养壁加,不要插到培养基液面下,容易产生气泡,会干扰O.D值读数;
5、为使CCK-8试剂和培养基充分混匀,建议在加入CCK-8试剂后轻轻振摇培养板。为了避免加样时由于CCK-8试剂在枪头上的残留所带来的误差,可以在加样前用培养基稀释CCK-8试剂并混匀后加样;
6、如果待测物质有还原性,就会和CCK-8试剂发生显示反应,增加吸光度,如果药物有氧化性则降低吸光度。请检查背景的OD值,即在不含细胞的培养基中加入药物,然后加入CCK-8试剂在一定时间内检测,和不加药物的培养基进行比较(只加CCK-8试剂),如果OD值明显偏高,则说明有反应,也可以在加CCK-8之前更换新鲜培养基,去掉药物影响。
7、加入待测物质的浓度需要多参考文献,选择合适的浓度梯度进行筛选。
8、尽量使用多通道移液器,可以减少平行孔间差异。
9、如果样品为高浑浊度的细胞悬液,可以设定600nm作为参比波长,扣除参比波长的OD值。


