浅谈银屑病动物模型
银屑病是什么?
皮肤由三层:表皮、真皮层和皮下层组成。每一层都有各种皮肤附属物,如汗腺、直立肌和皮脂腺。健康的皮肤会形成皮肤层并不断更新,死皮脱落,新皮再生,这就是我们所说的皮肤的自然更替。而作为以T细胞介导为主的自身免疫性皮肤病,银屑病(Psoriasis),又称牛皮癣,是一种慢性非感染性炎症性皮肤病,复发性高、可遗传,可能无法永久性治愈。患者皮肤更新缓慢,所以当新的皮肤层出现时,死细胞不会脱落,形成死细胞(角化细胞)的斑块或皮肤结痂。 这些斑块会引起疼痛、发炎,甚至四分五裂,产生伤口,可能出血也会形成鳞状皮肤。该病表现为躯体多处红斑、丘疹,覆以银白色鳞屑,发病不受年龄和地域限制,通常伴有糖尿病、高血压、抑郁症和非酒精性脂肪肝等疾病;患者表皮过度增生,皮肤中含有过多的免疫细胞,可产生大量的细胞因子、趋化因子和炎症分子。
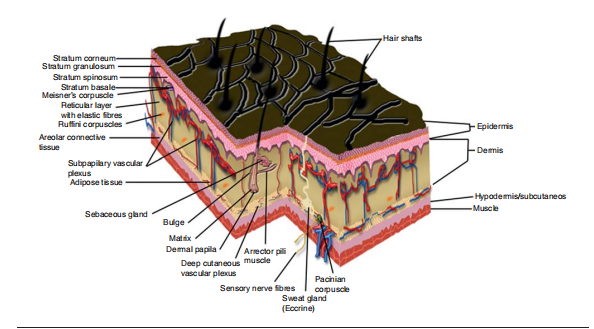
皮肤的结构(DOI:10.1517/17460441.2013.761202)

银屑病的组织病理学结构(https://blog.ho la.com/farmaciameritxell/)
患者的症状顽固、病因错综复杂,严重的甚至会致残,给个人、家庭及社会带来严重困扰,其发病机制尚未阐明,特别是在人类白细胞抗原HLA-C*06:02风险等位基因的存在下,链球菌感染、压力、吸烟、肥胖和饮酒等因素都会加重病情。银屑病目前还不能治愈,应在疾病发展早期开展治疗,同时改善生活方式,从而尽量减轻痛苦。
自20世纪80年代初以来,T细胞在银屑病发病机制中的重要性一直为人所知,许多经典免疫细胞(包括树突状细胞和中性粒细胞)和非经典免疫细胞(如角质形成细胞)参与了疾病的发生。这些细胞之间的通信主要通过细胞因子如TNFα、IFN-γ、IL-17和IL-22发生,并通过角质形成细胞的激活,驱动表皮的过度增殖和抗菌蛋白、生长因子和趋化因子的产生。这些因素促进了银屑病的特征性变化,包括血管生成、中性粒细胞浸润、辅助T细胞1型(Th1)和Th17细胞数量的增加,创造了一个自我维持的炎症循环。这些是长期存在的非循环的记忆T细胞,进化到能够提供对病原体的快速保护的程度,当被异常激活时,就会发挥作用。免疫学和遗传学研究已经证明IL-17和IL-23是银屑病发病的关键因素。通过生物疗法对这些细胞因子和TNFα的靶向免疫治疗,能够有效抑制疾病的发展。

银屑病的免疫发病机制和银屑病斑块(DOI:10.1016/S0140-6736(20)32549-6 )
而新药的开发、探究和临床前CRO,都需要一个比较理想的动物模型,相应的,它还应具有 以下的特征①相似的临床表现,如组织学性状和病理学情况;②炎症因子增多、血管化程度加深;③对银屑病常用药物敏感。
如何应对?
那现在都有哪些银屑病动物模型可供选择呢?小鼠模型可分为自发、基因工程(转基因和敲除)、异种移植和直接诱导。
一、基因工程小鼠:
采用基因编辑技术,过表达或敲除动物体内某种特定基因。KRT5-JunB/Jun 缺陷小鼠,具有与相似的皮肤炎症和关节炎表现] ;KRT14-IKKβ 缺陷小鼠,皮肤炎症明显、表皮增厚、分化异常;白细胞介素1α转基因小鼠模型,患关节炎,毛发脱落,身形消瘦,皮肤皱缩,还伴有动脉炎症。
二、自发疾病性动物模型:
在自然条件下出现,或者经遗传育种筛选得到的由于基因突变的产生的动物模型。目前发现的自发产生银屑病样病变的动物模型存在各种问题,尚未广泛使用,如Ttcfsn/ Ttcfsn鼠,会自发表现为皮肤鳞屑、炎症、角化过度的形状,但其生长周期短,加之表皮生长因子受体和IgE抗体水平高,且对常见的银屑病治疗药物无应答机制;ic/ic突变鼠,病理表现与临床结果不同等。
三、异体移植动物模型:
该模型可通过异种移植模型和同种不同品系小鼠间移植获得。前者的实验设计是将人体组织或细胞移植给免疫缺陷小鼠,如裸鼠(T 淋巴细胞免疫缺陷鼠)、SCID 小鼠(体液和细胞免疫双重缺陷小鼠)和AGR129 小鼠( T 淋 巴细胞、B 淋巴细胞和成熟的 NK 细胞缺失),目前最常用于新药研发的是SCID 小鼠,但其成本较高,对操作手法和实验环境有严苛的要求。
后者的实验方案的疾病复制效果并不佳,且小鼠种间的差异,会干扰到实验结果的评判,不建议采用。
四、急性炎症动物模型:
该模型可由药物诱导和的皮肤损伤两种方式获得。药物诱导的方法有:局部外用、真皮内注射和口服。咪喹莫特(IMQ)作为Toll样受体(TLR)7/8的激动剂,既能基本复制皮肤损伤的表型,也能使实验动物的免疫功能降低,这是与银屑病病人相似的,因而被广泛使用。而其他造模方法如真皮内注射白细胞介素;对小鼠造成机械损伤等,已逐渐弃用。

用于银屑病研究的小鼠模型(DOI:10.3390/ijms18122514)
拓普怎么做?
为了“让天下没有难治的疾病”这一愿景尽快落地,拓普生物已经打磨出一套成熟的IMQ诱导造模的实验方案。
实验动物:
SPF级BALB/c 小鼠,6-8 周龄
实验方法:
1. 小鼠经适应性饲养一周后,进行随机分组(实验组和对照组),然后背部脱毛;
2. 在皮肤暴露区涂抹 5%的IMQ 软膏,予同等剂量的凡士林软膏处理,连续6天;
3. 实验期间需每日观察小鼠的一般状态,包括进食进水、活动度、皮毛色泽等,如有死亡应该及时记录;为评估皮损严重程度,采用改良的银屑病皮损面积和严重程度指数(PASI)法,包括红斑、鳞屑、皮肤厚度三项指标,以0~4分进行计分(见表1)。评分频率为1天1次。
表1 PASI评分标准
0 | 1 | 2 | 3 | 4 | |
红斑 | 无红斑 | 红斑呈淡红色 | 红斑呈红色 | 红斑呈深红色 | 红斑极深 |
鳞屑 | 表面无可见鳞屑 | 分为部分皮损表面上覆有鳞屑,以细微的鳞屑为主 | 大多数皮损表面完全或不完全覆有鳞屑,鳞屑呈片状 | 皮损部位几乎全部被鳞屑覆盖,鳞屑呈层 | 皮损部位全部被鳞屑覆盖,鳞屑很厚成层 |
厚度 | 皮损与正常皮肤齐平 | 皮损较正常皮肤表面稍高 | 皮损中等度隆起,斑块的边缘为圆或斜坡型 | 皮损肥厚,隆起明显 | 皮损高度肥厚,明显凸起 |
4. 小鼠处死后取下造模区域处的皮肤组织,取一部分固定在福尔马林中,可用于后续的病理检测。
5. 小鼠皮损组织ELISA检测
取小鼠部分皮损组织,冰上匀浆后离心取上清,ELISA法测定上清中IL-23、IL-17、IL-22、TNF-α、IFN-γ的含量。
实验结果:
1. 表型观察:
经IMQ处理的小鼠,造模开始后0-6d,皮肤逐渐变厚,并伴有红斑、干燥银白色鳞屑,皮肤松弛且损伤严重。
2. 病理结果:
模型组小鼠背部皮肤和表皮厚度的表型表现及相应的组织学分析(H&E染色,x200),有明显的棘皮增生、角化不全、脓疱和脱屑,炎症性白细胞浸润真皮。

对照组和实验组 BALB/c小鼠的HE染色结果( DOI: 10.3892/ijmm.2017.2930)
高达90%的新药研发在临床III期失败,主要原因是缺乏临床疗效,这表明具有高度预测性和可操作性的人类疾病动物模型是非常重要的。在慢性炎症反应、炎症循环和免疫代谢动力学的研究中,银屑病动物模型将有更多应用,有助于开发新的治疗方法。





