浅谈--创新药物申报
新药(NewDrugs)是指化学结构、药品组分和药理作用不同于现有药品的药物。根据《药品管理法》以及2007年10月1日开始执行的新《药品注册管理办法》,新药系指未曾在中国境内上市销售的药品。对已上市药品改变剂型、改变给药途径、增加新适应症的药品,不属于新药,但药品注册按照新药申请的程序申报。2015年对新药的概念进行了更改,新药系指未曾在中国境内外上市销售的药品。
新药分类:化学药物、天然药物、生物技术药物
新药注册的申报过程中需要资料包括:综述资料、药学研究资料、药理毒理研究资料、临床试验资料
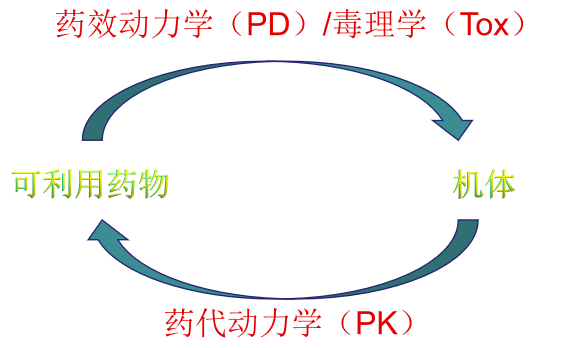
新药申报过程中与药理学、毒理学、药代动力学等相关学科研究具有重要意义。其中包括:
(1) 研究药物、机体间相互作用的特点、规律与机制
(2) 研究药物的暴露量与生物学行为之间关系
(3) 研究药物在机体的作用下所发生的变化及其规律,包括药物在体内的吸收、分布、代谢和排泄过程,特别是血药浓度随时间变化的规律、影响药物疗效的因素等
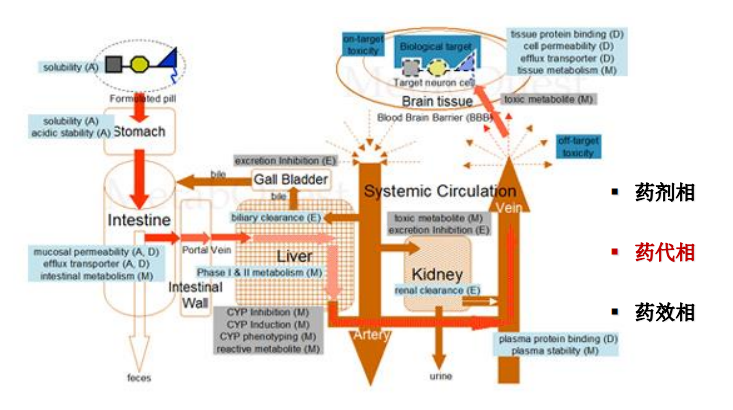
新药注册主要包括以下三大内容:
支持新药注册的DMPK研究内容:
IND:IND主要目的是提供足够信息来证明药品在人体进行试验是安全的,以及证明针对研究目的的临床方案设计是合理的。
NDA:当人体试验第三阶段完成,所需非临床试验已告结束,则可以出具一套资料,向FNS申请新药上市许可之核准,NDA主要目的是确保上市药品安全有效和质量可控。
ANDA:ANDA的申请即为“复制”一个已被批准上市的产品。其中,这里的“复制”是指其与该上市药品具有相同的活性成分、剂型、规格、服用方式及适应症等。仿制药申请被称为简短的(abbreviated),是因为这类申请不需要提供临床前(动物)和临床(人体)数据来证明其安全性和有效性。取而代之的是,仿制药申请者必需提供产品生物等效性的证明材料(比如与原研药相比没有区别)。一旦此类药品获得批准,申请者可以生产并上市这一安全有效且价格低廉的替代物。
支持新药注册的DMPK法规要求:
Ø 药品审评中心:
(1) 药物非临床药代动力学研究技术指导原则
(2) 化学药物临床药代动力学研究技术指导原则
(3) 化学药物制剂人体生物利用度和生物等效性研究技术指导原则
(4) 药物相互作用研究指导原则
(5) 化学药物儿科人群药代动力学研究技术指导原则
(6) 药物毒代动力学研究技术指导原则
(7) 生物类似药研发与评价技术指导原则(征求意见稿)
Ø 中国药典:
(1) 生物样品定量分析方法验证指导原则
(2) 药物制剂人体生物利用度和生物等效性试验指导原则
支持新药注册的DMPK基本原则:
(1) 试验目的明确,体现药物、剂型设计思路
(2) 试验设计合理
(3) 分析方法可靠
(4) 所得参数全面,满足评价要求
(5) 对试验结果进行综合分析与评价
(6) 具体问题具体分析
小结:
从事新药安全性研究及申报要符合国家药品监督管理局《药品非临床研究质量管理规范》(GLP)的相应要求,实验动物应符合国家药品监督管理局的有关要求,以保证各项实验的科学性和实验结果的可靠性。





